Jäsningsrör identifierar bakterien!
Voges-Proskauer (VP) testet detekterar acetoin som i sin tur kan ange 2,3-butandiolproduktionen som uppkommer då bakterierna bryter ned syror. Glukos-peptonmediet kommer att rödfärgas efter tillsats av α-naftol och kaliumhydroxid om acetoin oxideras till diacetyl. Diacetylen kommer sedan att reagera med nedfallsprodukter från pepton och det är det som ger mediet dess röda färg. Används exempelvis för att identifiera alfastreptokocker tillhörande millerigruppen.
Med urearör testas ifall bakterier har enzymet ureas som katalyserar reaktionen då urea klyvs till bland annat ammoniak. Frisättning av ammoniak leder till att pH:t höjs och då mediet innehåller pH-indikatorn fenolrött kan denna pH-höjning detekteras. Bildar bakterien ureas blir det en färgförändring och mediet blir rött. Exempel på bakterier som bildar ureas är Klebsiella och Proteus medan E. coli saknar detta enzym.
Även ett orthonitrophenylgalactoside-test (ONPG) används vid identifiering av bakterier som tros tillhöra familjen Enterobacteriaceae då de i denna familj kan bryta ned laktos, med hjälp av enzymet β-galaktosidas, till glukos och galaktos. Då β-galaktosidas även spjälkar den färglösa ONPG kan detta test användas då ONPG:s nedbrytningsprodukter gör så att lösningen blir gul. Exempel på bakterier som bryter ned laktos är E. coli och Klebsiella medan Proteus klarar inte av det.
Med ett SIM-rör testas tre olika egenskaper samtidigt. Divätesulfidproduktionen hos en bakterie kan bestämmas med detta test då vissa bakterier bryter ned svavelhaltiga aminosyror såsom cystein. Denna produktion kan påvisas genom att jonen Fe3+ finns i mediet. Om en positiv reaktion uppstår syns en svart fällning eftersom järnet binder in till sulfiden. I detta rör kan även indol påvisas då vissa bakterier har tryptofanmetabolism, det vill säga att tryptofan klyvs till indol, ammoniak och pyrodruvsyra med hjälp av enzymet tryptofanas. Vid tillsats av Kovac’s reagens, innehållandes paradimetylaminobenzaldehyd, blir lösningen röd vid närvaro av indol. Även rörligheten kan bestämmas genom att provet stickympas ned i röret. Sprids grumligheten ut i röret så är bakterien rörlig. Genom att SIM-röret innehåller endast 0,35% agar fås ett semi-fast medium vilket är idealt för analyserandet av rörligheten hos bakterien.
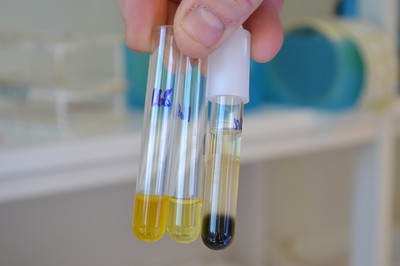
Här ses, från vänster räknat, ett ONPG-rör, ett urearör och slutligen ett SIM-rör.

Här är det inte svart i SIM-röret men man kan se att bakterien är
Med ett mannitol/gas-test kan syrabildning ses då mediet innehåller pH-indikatorn fenolrött som slås om från rött till gult då pH:t sänks. Syror utsöndras då sockret mannitol, som utgör kolkällan i näringsmediet, spjälkas.
Ja det var det som jag hade tänkt att säga om jäsningsrören. Hoppas att ni tyckte det var lika spännande som jag tyckte! Tänk så smarta och kunniga ni blev nu :)
Varför är vissa bakterier negativa medans andra är positiva?
Gramfärgning
Med hjälp av gramfärgning kan bakterier klassificeras som grampositiva eller gramnegativa då deras cellväggar har olika uppbyggnad. De grampositiva bakterierna har ett tjockare peptidoglykanlager samt innehåller teikonsyra. De gramnegativa bakterierna har ett tunnare peptidoglykanlager men de har även ett yttermembran som innehåller lipopolysackarider (LPS).
Innan själva gramfärgningen kan påbörjas så måste bakterierna på objektsglaset fixeras. Detta sker genom att objektsglaset förs emot en låga ett antal gånger. Därefter appliceras kristallviolett som får verka en stund innan det sköljs av med Lugols lösning, som innehåller jod. Även detta får verka en stund innan det sköljs av med vatten och därefter alkohol. Att de gramnegativa bakterierna tappar färgen efter sköljning med alkohol beror på att deras cellvägg är lipidrik och lipiderna löser ut i alkoholen. De grampositivas cellvägg är inte alls lika lipidrik och färgen löses således inte ut. För att de är gramnegativa bakterierna ska kunna färgas in så nyttjas även en motfärg som exempelvis safranin. Även safranin får verka en stund innan det sköljs av med vatten. De olika isolaten kan nu examineras i ett ljusmikroskop.
